Unser Immunsystem besteht nicht nur aus Antikörpern und Lymphozyten. Das sogenannte Komplementsystem ist Teil des angeborenen, unspezifischen Immunsystems und besteht aus mehr als 40 Plasmaproteinen, die erst im Fall einer Infektion aktiviert werden. Diese Komplementfaktoren schützen einerseits noch nicht befallene Nachbarzellen und grenzen so eine Entzündung ein und unterstützen andererseits die Bekämpfung von Bakterien und Viren, indem sie proinflammatorische Reaktionen wie die Freisetzung von Histamin aber auch die Aktivität der Fress- und Killerzellen stimulieren.
Aber welche Faktoren sind verantwortlich, wenn das Komplementsystem nicht richtig arbeitet, also nicht oder nicht ausreichend aktiviert wird? Dazu lohnt sich ein Blick darauf, wie diese Aktivierung konkret funktioniert und welche Kettenreaktion sie auslöst.
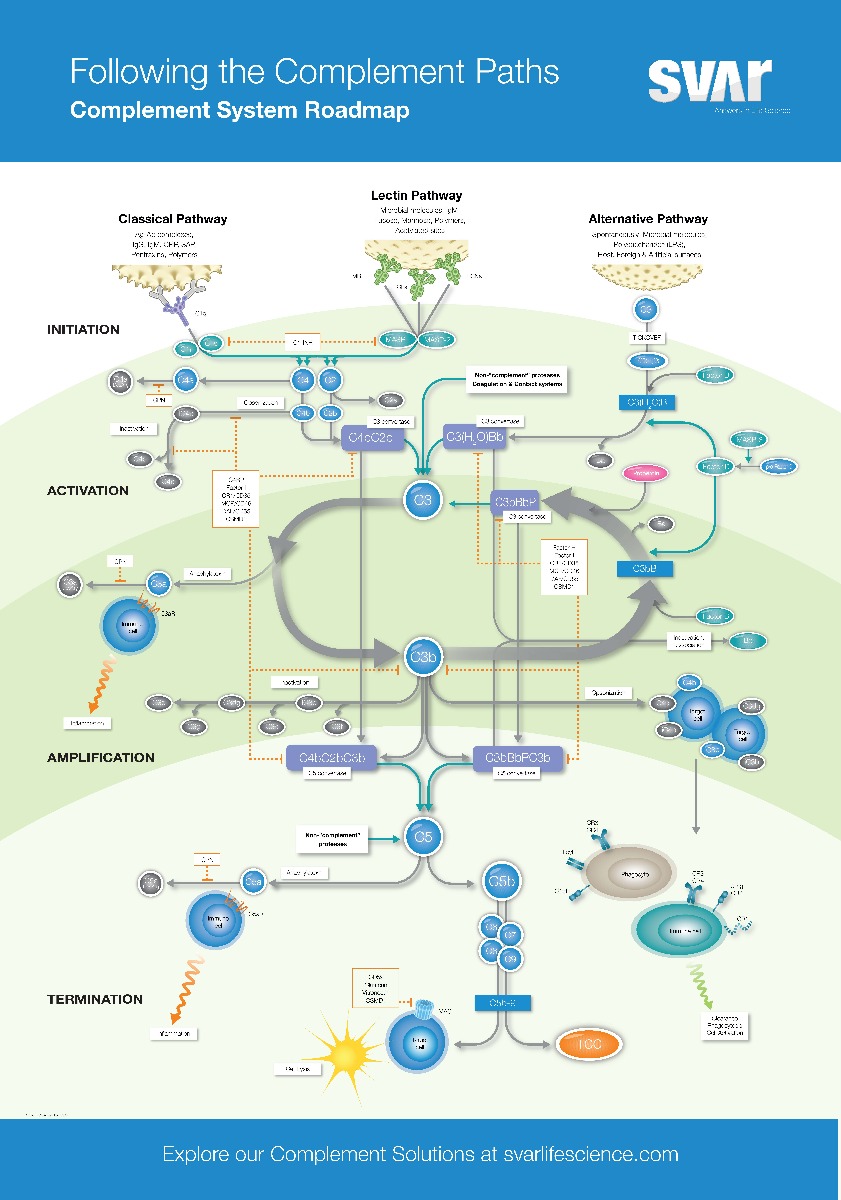
Wie wird das Komplementsystem aktiviert?
Es gibt drei Wege der Aktivierung: den klassischen, den alternativen und den erst später entdeckten MBL (mannose-binding lectin) Weg, meist Lektinweg genannt. Alle drei Aktivierungswege lösen eine Kettenreaktion aus mit dem Ziel, die Krankheitserreger möglichst rasch zu erkennen und zu bekämpfen. Dabei werden die Proteine des Komplementsystems in kleinere Fragmente gespalten. Ein Schlüssel ist dabei die Bildung des Enzymkomplexes C3-Konvertase, das C3 in C3a und C3b spaltet. C3b bindet an die Oberfläche des Bakteriums oder Virus und aktiviert weitere Komplementfaktoren. Dadurch wird eine Entzündungsreaktion ausgelöst, und der Erreger wird markiert, damit er von Immunzellen wie Makrophagen und Neutrophile Granulozyten besser erkannt und phagozytiert werden kann.
Zusätzlich zur Markierung des Erregers durch C3b trägt das Komplementsystem auch zur direkten Zerstörung des Erregers bei. Durch C3-Konvertase wird auch C5 in C5a und C5b gespalten. C5b bindet an die Oberfläche des Erregers und rekrutiert weitere Proteine, um das Membranattacke-Komplex (MAC) zu bilden. Der MAC führt zur Bildung von Poren in der Membran des Erregers, was zum Zelltod führt.
Der klassische Weg über Antikörper
Der klassische Komplementsignalweg wird durch Antikörper aktiviert, die spezifisch an krankheitserregende Moleküle binden. Sobald ein Antikörper an ein Bakterium oder Virus gebunden ist, kann er das Komplementsystem aktivieren, indem er das erste Enzym der Kaskade, C1, bindet. Dadurch wird dann die oben beschriebene Reaktionskette in Gang gesetzt.
Der Lektinweg
Im Gegensatz zum klassischen Weg wird der Lektinweg nicht durch Antikörper, sondern durch Lektine aktiviert, die sich an krankheitserregende Moleküle binden.
Zu diesen Lektinen gehört das MBL (Mannose-bindendes Lektin), das sich an Kohlenhydrate auf der Oberfläche von Bakterien und Viren bindet. Sobald sich das MBL an den Kohlenhydraten des Erregers bindet, wird es aktiviert und bildet mit weiteren Proteinen einen Komplex, der als MBL-assoziierte Serinprotease (MASP) bezeichnet wird. Dieser Komplex spaltet die Proteine und leitet die weitere Aktivierung des Komplementsystems ein.
Der alternative Weg
Im Gegensatz zum klassischen und Lektinweg funktioniert der alternative Weg unabhängig von Antikörpern oder Lektinen. Stattdessen wird der alternative Signalweg durch eine ständige niedrige Aktivierung von Komplementproteinen im Blutplasma aufrechterhalten.
Der alternative Signalweg beginnt mit der spontanen Spaltung von C3 in C3a und C3b und löst so die Reaktionskette aus.
Welche Rolle spielen Faktor P (Properdin) und Faktor H im alternativen Signalweg?
Die ständige niedrige Aktivierung des alternativen Signalwegs wird durch Proteine wie Faktor H und I reguliert, die eine zu starke Aktivierung des Komplementsystems auf körpereigenen Zellen verhindern. Faktor H bindet an C3b und verhindert so dessen Aktivierung, während Faktor I C3b inaktiviert.
Properdin ist ein Regulatorprotein, das die Aktivierung des alternativen Signalwegs verstärkt und stabilisiert. Properdin bindet an C3b, die C3-Konvertase des alternativen Signalwegs, und stabilisiert sie, wodurch sie länger aktiv bleibt und mehr C3-Moleküle spaltet. Dadurch wird die Produktion von C3b und C3a verstärkt und die Markierung und Zerstörung von Krankheitserregern durch das Komplementsystem verstärkt.
Darüber hinaus kann Properdin auch direkt auf krankheitserregende Bakterien binden und sie dadurch für Immunzellen markieren und die Komplementvermittlung von Zelltod und Zerstörung fördern.
Ursachen für Komplementdefekte diagnostizieren
Kennzeichen für einen Komplementdefekt ist eine fehlende oder defekte Proteinspaltung. Diese kann sowohl vererbt sein als auch durch bakterielle Infektionen ausgelöst werden. Die Diagnose konzentriert sich daher darauf, diese Proteine und ihre Spaltungsreaktionen zu detektieren. In vielen Fällen reicht dazu die Bestimmung der Proteinfragmente C3 und C4. Um sowohl einen Defekt als auch die Aktivierung des Systems zu erfassen, braucht es jedoch ein stufenweises Vorgehen, um einerseits alle Aktivierungswege als auch einzelne Faktoren untersuchen zu können.
Mit welchen Produkten kann Szabo-Scandic Sie in der Komplementdiagnostik unterstützen?
 Mit den funktionellen Komplementassays von SVAR können Sie entweder alle drei Wege auf einmal oder jeden für sich in Form eines ELISAs abbilden:
Mit den funktionellen Komplementassays von SVAR können Sie entweder alle drei Wege auf einmal oder jeden für sich in Form eines ELISAs abbilden:
- WIECOMPL300 WIESLAB® Complement System Screen, ELISA
- WIECOMPLCP310 WIESLAB® Complement System Classical Pathway, ELISA
- WIECOMPLMP320 WIESLAB® Complement System MBL Pathway, ELISA
- WIECOMPLAP330 WIESLAB® Complement System Alternative Pathway, ELISA
Weitere Komplementassays (ELISA):
 Zusätzlich bieten wir einen cell-based-assay mit ready-to-use Zellen an:
Zusätzlich bieten wir einen cell-based-assay mit ready-to-use Zellen an:
Wir haben auch ELISAs für Faktor H (CE-IVD) und Faktor P (RUO) im Angebot. Bitte wenden Sie sich hierfür direkt an unser Produktmanagement.

 English
English